 順天堂大学大学院医学研究科・オートファジー調節化合物探索研究講座の古屋徳彦助教、神経学講座の服部信孝教授らの研究グループは、オートファジーレセプターの一つNDP52がミトコンドリア内に侵入し、ミトコンドリアRNA poly(A)ポリメラーゼ(MTPAP)と相互作用することで不良ミトコンドリア選択的なオートファジー(マイトファジーという)を促進することを発見した。
順天堂大学大学院医学研究科・オートファジー調節化合物探索研究講座の古屋徳彦助教、神経学講座の服部信孝教授らの研究グループは、オートファジーレセプターの一つNDP52がミトコンドリア内に侵入し、ミトコンドリアRNA poly(A)ポリメラーゼ(MTPAP)と相互作用することで不良ミトコンドリア選択的なオートファジー(マイトファジーという)を促進することを発見した。
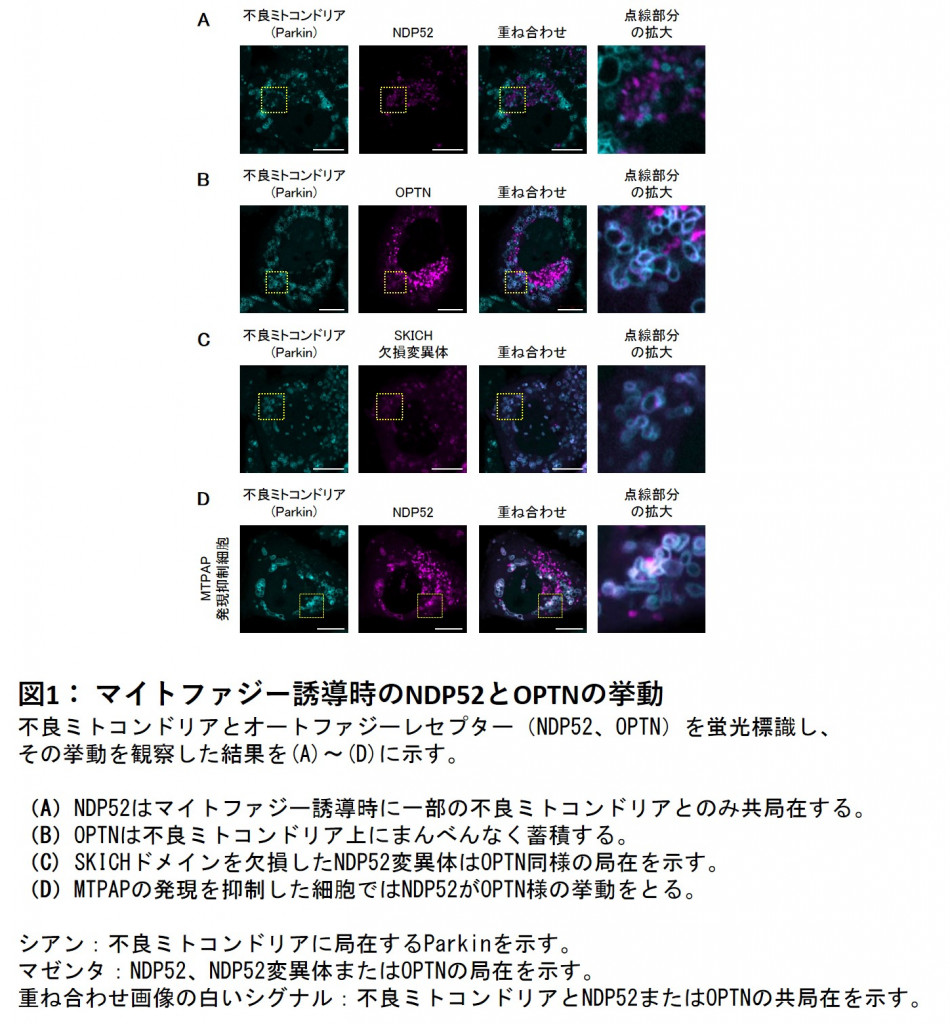
研究では、培養細胞を用い、PINK1/Parkin介在性マイトファジー誘導時におけるオートファジーレセプターの挙動をタイムラプス顕微鏡観察によって調べた。その結果、同じオートファジーレセプターであってもOPTNは不良ミトコンドリア上にまんべんなく蓄積する挙動をとるのに対し、NDP52は一部のミトコンドリアに一定時間局在するという挙動をとることを見出した。
またNDP52のSKICHドメインという部分を欠損させた変異体ではOPTNと類似の挙動に変化することから、NDP52特有の挙動はSKICHドメインによるものと考えた。そこで、SKICHドメインを介してNDP52と結合するタンパク質を探索した結果、MTPAPというタンパク質を同定した。
MTPAPの発現を抑えた細胞においても、NDP52の挙動はOPTNと類似したものに変化することから、NDP52特有の挙動はSKICHドメインを介したMTPAPとの結合によるものと示唆された。
しかし、細胞質に存在するNDP52とミトコンドリア内に局在するMTPAPは、ミトコンドリアの外膜、内膜という2つの膜に隔てられて通常出会うことはできない。NDP52とMTPAPがどうやって結合するのかを検討した結果、プロテアソームというタンパク質分解酵素複合体によってミトコンドリア外膜に穴があくことで、NDP52がミトコンドリア内部に侵入することがわかった。
NDP52とMTPAPが結合した複合体は、NDP52単独よりオートファゴソーム膜上に存在するタンパク質LC3との親和性が高く、NDP52-MTPAP複合体が形成されたミトコンドリアはよりマイトファジーを受けやすいことがわかった。
今回の研究結果は、細胞が不良ミトコンドリアを取り除く新しいメカニズムを見つけたというだけでなく、細胞質のタンパク質がミトコンドリア内部(マトリックス)に侵入し、ミトコンドリア内部のタンパク質と相互作用するという機構が存在することを示した世界初の知見であり、細胞生物学的に非常に重要な発見であるとしている。
この研究成果は、不良ミトコンドリア蓄積を原因とするパーキンソン病などの神経変性疾患の予防・治療につながるものと期待される。