薬事法の抜本改正、補助事業などを追い風に市場拡大
iPS細胞や細胞シートを使った再生医療を国の責任と定め財政、税制の面から研究開発と実用化の支援を盛り込んだ再生医療推進法の成立や細胞シートなど再生医療製品、再生医療機器の安全性を早期に承認することなどを盛り込んだ薬事法の抜本改正は、再生医療製品、再生医療機器、再生医療サービスを包含した新しいビジネス「再生医療ビジネス」の勃興を期待させる。
同推進法は、企業、大学の医工連携や大学、医療機関の連携などを促進して特区指定、補助事業による再生医療製品、再生医療機器の研究開発、実用化を促進することで、再生医療ビジネスの創出、国際競争力の強化に繋げる。
今国会で成立する運びの薬事法改正は、再生医療製品や再生医療機器を現行の医薬品、医療機器と別に区分し規制を設けた。iPS細胞や細胞シートなどの再生医療製品については「早期承認制度」を導入し、有効性と安全性が認められれば治験症例実績が少なくても特例的に薬事承認する。その後、臨床での実績をもとに7年以内に改めて承認を与える2段階承認とした。また、再生医療機器を製造するだけで販売を行わない事業者を対象とした製造業許可制度を登録制に変更。合わせて高度管理医療機器の内、後発品については、国が認証機関として認めた民間の第3者認証に移行し、市場での製品投入をスピードアップする。同時に、厚生省所管の医薬品医療機器総合機構は、人工心臓など新規性の高い再生医療機器に限定して重点的に審査・承認し、審査期間の短縮を図る。
これまで薬事法は、医薬品を前提に作られた。しかし、同じ薬事法で規制されてきた細胞シートなどの再々医療製品は、品質にバラツキがあることや再生医療機器についても要素技術、材料に違いがあるなど薬事法で規制することが問題視されていた。
一方、経産省は、バイオ創薬や再生医療機器を含む医療機器全体が欧米の攻勢で辛苦をなめる中で、iPS細胞や細胞シートに代表される日本発の再生医療製品や再生医療機器、再生医療サービスを含めた再生医療ビジネスを成長のエンジンとして位置付け再生医療の実用化、産業化を促進する。
具体的には(1)細胞培養加工機器や周辺機器に必要な基準の標準化(JIS)を進める(2)効率的な細胞の培養を実現するため医療機関から外部の専門機関への委託を可能とする委託制度の導入と安全性に関する審査基準の整備(3)医療機関や大学が行う再生医療の臨床研究で日本製の機器や薬品を使用して性能を調べる場合、研究費を補助するなどの施策を講じて再生医療の技術向上と実用化の促進及び産業化の形成を図る。
経産省は「我が国の再生医療は研究レベルでトップのレベルにある半面、欧米に比べて実用化が遅れている。事業化を進めるにあたってコスト削減のポイントや医療機関と事業者との責任分担、審査制度の透明化、保険制度の在り方を含めて施策を講じ再生医療の事業化、ビジネス形成に努めて行きたい」(生物産業化学課)としている。
現在、iPS細胞、細胞シートを中心とした再生医療製品、再生医療機器、サービス支援を包含した国内の再生医療ビジネスは、約260億市場と規模は小さく黎明期にある。しかし、新法を追い風にして今年度から新たなビジネス創出に向けた本格的な離陸が始まる。今後、新規参入の増加や需要の高まりを要因に再生医療ビジネス市場が一挙に拡大、2020年度には8000億円市場を形成する有望市場に発展する見通し。
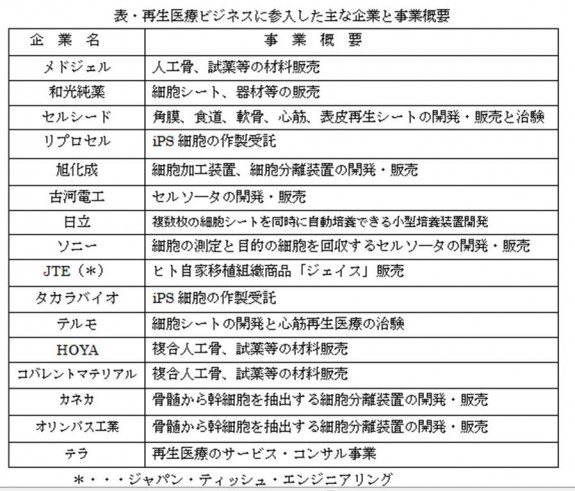
表に再生医療ビジネスに参入した主な企業の事業概要を示す。

コメント