 再生医療向け医薬品の製造・販売・輸出入などを手掛ける株式会社オーガンテクノロジーズ(東京都港区)と、国立研究開発法人理化学研究所(理事長・松本紘氏)はこのほど、再生医療分野である「毛包器官再生による脱毛症の治療」に向けた臨床研究の前段階である非臨床試験を開始すると発表した。
再生医療向け医薬品の製造・販売・輸出入などを手掛ける株式会社オーガンテクノロジーズ(東京都港区)と、国立研究開発法人理化学研究所(理事長・松本紘氏)はこのほど、再生医療分野である「毛包器官再生による脱毛症の治療」に向けた臨床研究の前段階である非臨床試験を開始すると発表した。
毛包再生医療では、男性型脱毛症(AGA)患者を対象とする治療から開始することを想定している。その後、女性型脱毛症や瘢痕性脱毛症や先天性脱毛症の患者を対象とした開発を進める予定。
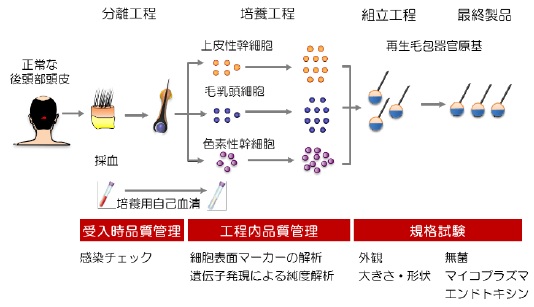
AGA患者自身の正常な後頭部頭皮から採取した毛包から、標準作業手順書(SOP)に定められた方法に従って、上皮性幹細胞と毛乳頭細胞、色素性幹細胞をそれぞれ取得して培養。生体外で培養、増幅後、それぞれの細胞を回収し、新規再生毛包器官原基製造法を用いて再生毛包器官原基を製造する。
この再生毛包器官原基には、毛穴製造用のナイロン縫合糸が挿入されており、発毛を可能としている。品質管理としては、培養途中の工程内品質管理試験として、培養工程中に問題がないことをフローサイトメーターによるタンパク質の発現やPCRによる遺伝子発現などを検査する。また出荷規格試験では、最終製品が規格に従って製造できているかどうかを形態観察や細胞の生細胞率、無菌試験、マイコプラズマ否定試験などの汚染検査を行う。
非臨床試験用の製造サンプルで実施する安全性試験では、一般毒性および造腫瘍性試験として、マウスの背部皮下にヒト再生毛包器官原基を複数移植し、全身状態や移植部位の様子を一定の期間継続観察する。試験終了時には、移植部位周辺、並びに全身の組織の病理組織学的検査および免疫組織学的検査を実施し、ヒト再生毛包器官原基に由来する毒性や悪性腫瘍の形成がないことを検査する。
なお、これらの製造方法、並びに品質管理方法、非臨床安全性試験については、将来の治験の実施に向けて、医薬品医療機器総合機構(PMDA)と連携しながら進めていく。
今後の計画については、7月より非臨床試験用の製造を開始し、動物を用いた非臨床安全性試験を実施する。2018年中には安全性試験を終了する予定。非臨床安全性試験の結果をもとに、特定認定再生医療等委員会および認定臨床研究審査委員会での審議をうけ、当該委員会の承認後、厚生労働大臣への提供計画の提出を行い、臨床研究の実施へと移行するとしている。